Pflanzliches Eiweiß soll minderwertig sein und, im Fall von Soja, sogar krank machen. Tierisches Eiweiß wird dagegen als hochwertig und wichtig für Jung und Alt wahrgenommen. Doch diese Annahmen entsprechen nicht den Tatsachen, obwohl sie vorherrschend sind in unserer modernen Gesellschaft. Viele Menschen im Spannungsfeld von tierischem und pflanzlichem Protein treffen dadurch Ernährungsentscheidungen, die zu Lasten ihrer Gesundheit gehen können.
Ist tierisches oder pflanzliches Eiweiß besser?
Diese Frage versucht dieser Beitrag mit einem Blick auf die aktuellen, wissenschaftlichen Erkenntnisse zu beantworten. Die Antwort ist nicht nur für ernährungsbewusste Menschen und Sportler zentral, sie wird gerade für die Allgemeinbevölkerung immer wichtiger werden. So wird es auch gelegentlichen Fleischessern immer einfacher fallen, den tierischen gegen den pflanzlichen Burger zu tauschen.
Im Folgenden werden pflanzliches und tierisches Eiweiß in 15 Kategorien zu Gesundheit, Leistung und Umwelt verglichen . Der Sieger einer Kategorie erhält einen Punkt.
Welches Protein ist das bessere?
Zusammenfassung
Was sind tierische Eiweiße?
Tierische Eiweiße werden wie pflanzliche Eiweiße aus Ketten von Aminosäuren zusammengesetzt. Jedes Eiweiß besitzt eine ganz individuelle Aminosäurezusammensetzung, in welcher sich pflanzliche und tierische Eiweiße häufig unterscheiden. Die Proteinquelle bestimmt also die Zusammensetzung der aufgenommenen Aminosäuren. Wenn man den kalkulierten Aminosäurebedarf des Menschen mit verschiedenen Proteinquellen vergleicht, ergibt sich daher häufig eine Aminosäure, von der im Verhältnis am wenigsten enthalten ist - die limitierende Aminosäure.
Limitierende Aminosäure
Bei der isolierten Betrachtung einzelner Proteinquellen gibt es innerhalb der pflanzlichen häufiger eine limitierende Aminosäure. Durch die alltägliche Kombination von pflanzlichen Proteinquellen vervollständigt sich das Aminosäuremuster im Körper zwar, doch der Punkt geht, trotz eingeschränkter praktischer Relevanz, an tierisches Eiweiß.
Anaboles Potenzial für Muskelaufbau
Verzweigtkettige Aminosäuren und ganz besonders Leuzin gelten als sehr anabol. Da der Gehalt dieser Aminosäuren in tierischem Eiweiß höher als in pflanzlichem ist, wurde tierischem Eiweiß stets das höhere, anabole Potenzial zugesprochen. Mittlerweile gibt es jedoch einige Untersuchungen, die sich den Muskelzuwachs über längere Zeiträume angeschaut haben: dort gab es kein Unterschiede zwischen tierischem und pflanzlichem Protein in Bezug auf die Muskelmasse. Es könnte sein, dass Aminosäuren wie Leuzin zwar besser darin sind, die kurzfristige Muskelsynthese zu aktivieren, dies über lange Sicht aber keinen Unterschied für den tatsächlichen Muskelzuwachs macht. Weil die Faktenlage nicht eindeutig ist, gibt es hier ein Unentschieden.
Beste Proteinquelle für sportliche Leistung
Beim Einfluss der Proteinquelle auf die sportliche Leistung sieht es ähnlich aus. Untersuchungen für den Einfluss tierischen oder pflanzlichen Proteins auf Ausdauer und Kraft zeigen gemischte Ergebnisse. Die Faktenlage ist nicht eindeutig. Sicher ist jedoch, dass sich pflanzenbasierte Ernährung gut eignet, um die Ausdauer, das Durchhaltevermögen, die Regeneration oder die Immunabwehr von Athleten zu unterstützen. Unentschieden.
Verdaulichkeit des Proteins
Nach der Verarbeitung von pflanzlichen Proteinen, zum Beispiel über einweichen und kochen, nähert sich deren Verdaulichkeit den von tierischen Eiweißen an. Vergleicht man unbehandelte Lebensmittel, so weisen tierische Proteinquellen höhere Werte für die Verdaulichkeit auf. Der Grund sind meist sekundäre Pflanzenstoffe, wie zum Beispiel Phytinsäure. Als sekundäre Pflanzenstoffe sichern sie das Überleben der Pflanze und sind unserer Gesundheit zuträglich: So konnte zum Beispiel gezeigt werden, dass Erbsenprotein die Aufnahme von Cholesterin aus dem Nahrungsbrei behindert. Je nach Gehalt können manche sekundäre Pflanzenstoffe jedoch auch die Aufnahme von erwünschten Nährstoffen aus dem Nahrungsbrei behindern. Da die Verdaulichkeit einzelner, unbehandelter tierischer Lebensmittel höher ist, geht dieser Punkt an tierisches Eiweiß.
Säurelast für Nieren und Co.
Tierische Eiweiße sind die größere Herausforderung für unsere Entgiftungsorgane, die Nieren. Sie enthalten mehr schwefelhaltige Aminosäuren, mehr Natrium in Relation zu Kalium und weniger Magnesium in Relation zu Kalzium im Vergleich zu pflanzenbasierten Proteinen. Die Zusammensetzung der Nährstoffe ist letztlich dafür verantwortlich, wie viele chemisch als sauer definierte Stoffe von den Nieren verarbeitet werden müssen. Daher spricht man in der Literatur von einer höheren Säurelast durch tierische Lebensmittel und Proteine.
Krebs und tierisches Eiweiss
Krebs ist ein komplexes Thema. Dennoch gibt es einige Hinweise darauf, dass tierisches Eiweiss die Entstehung von Krebs begünstigen könnte. Die beobachtete Verbindung von verarbeitetem und rotem Fleisch und Krebs veranlasste die WHO dazu, diese tierischen Eiweißquellen als „krebserregend“ und „wahrscheinlich krebserregend“ einzustufen. Zudem begünstigt tierisches Protein einen anabolen Stoffwechsel – das Wachstum jeglicher Zellen, egal ob von guten oder schlechten, wie Krebszellen. Für natürliche Quellen pflanzlichen Proteins wird in der Literatur entweder kein Effekt auf Krebs entdeckt, oder ein schützender.
Insulinresistenz durch tierische Proteine
Insulinresistenz ist ein Risikofaktor für Herz-Kreislauf-Erkrankungen. Eine Maßnahme die eigene Insulinresistenz zu vermindern und folglich die Insulinsensitivität zu verbessern, ist der Austausch von tierischen gegen pflanzliche Proteinquellen. Denn tierisches Protein und besonders die verzweigtkettigen Aminosäuren Leuzin, Isoleuzin und Valin stehen im Zusammenhang mit hoher Insulinausschüttung und Insulinresistenz.
Diabetes-Risiko
Wenn tierisches Protein die Insulinresistenz verstärkt, begünstigt es die Entwicklung von Diabetes - es kann das Risiko für Diabetes erhöhen. Pflanzliches Protein wird dagegen immer häufiger zur Behandlung von Diabetes empfohlen. Der Austausch von relativ geringen Mengen tierischen Proteins gegen pflanzliches Protein kann das Risiko für Diabetes merklich verringern.
Übergewicht und Body-Mass-Index
Untersuchungen zeigen: Menschen die am meisten tierisches Protein konsumieren, haben den höchsten BMI. Der Austausch von tierischem gegen pflanzliches Protein hingegen kann das Risiko für Übergewicht reduzieren. Besonders Menschen, die Übergewicht reduzieren wollen, können von diesem Tausch profitieren.
Herz-Kreislauf-Erkrankungen durch Atherosklerose
Risikofaktoren für Herz-Kreislauf-Erkrankungen wie Gesamt- und LDL-Cholesterin stehen im Zusammenhang mit tierischem Protein. Vermutlich daher ist tierisches Protein mit einem höheren Risiko für Herzerkrankungen verbunden, pflanzliches Eiweiß mit einem geringeren. Der Austausch von tierischem gegen pflanzliches Protein kann das Risiko reduzieren.
Gesamtsterblichkeit
Einige Übersichtsstudien legen nahe, dass tierisches Protein im Vergleich zu pflanzlichem Protein ungünstig für die Sterblichkeit ist. Weniger tierisches Protein zu konsumieren, so könnte man sagen, wirkt lebensverlängernd.
Einfluss auf die Umwelt
Durch die schlechte Futterverwertung der Nutztiere kommen je nach Tier nur 3-8 % des verfütterten Proteins bei uns Menschen an – über 90 % des Futters geht für die menschliche Ernährung verloren. Durch diesen biologischen Zusammenhang ergibt sich die Klimaproblematik. Denn Tierhaltung und die Versorgung der Menschen mit tierischem Protein kostet immense Agrarflächen, für die nicht nur in Südamerika Regenwälder abgebrannt werden. Folglich führt der Konsum von tierischem Protein zu höherem Wasserverbrauch, Artensterben oder Treibhausgasausstoß.
Ethik der Proteinquelle
Auch wenn im Sprachgebrauch häufig der Begriff „artgerechte Haltung“ vorkommt, zum Beispiel in Verbindung mit Verbänden für biologischen Landbau, so ist das innerhalb der industriellen Massentierhaltung, die auf Gewinnmaximierung ausgelegt ist, unmöglich. Daher ist tierisches Protein mit dem Leid von Nutztieren verknüpft.
Nierengesundheit
Pflanzliches Eiweiß ist schonender für die Nieren. Zur Unterstützung der Nierengesundheit empfiehlt die Amerikanische Nierenstiftung eine Ernährung mit pflanzlichen Proteinen. Eine pflanzenbasierte Ernährung bietet sogar gute Chancen, eine bestehende Nierenerkrankung zu bekämpfen.
Begleitstoffe der Proteinquelle
Pflanzliches Protein hat viele gesundheitsförderliche Stoffe zu bieten, die mit dem Lebensmittel eingenommen werden. Tierisches Protein wiederum wird von Stoffen wie Cholesterin oder gesättigten Fetten begleitet, die als Risikofaktoren für bestimmte Erkrankungen gelten. Die Einnahme von viel pflanzlichem Protein aus natürlichen Lebensmitteln ist dadurch mit exzellenter Nährstoffversorgung verknüpft.
Tierische und pflanzliche Eiweiße und limitierende Aminosäuren
Tierische und pflanzliche Eiweiße Unterscheiden sich in der Gewichtung mancher Aminosäuren. Tierisches Eiweiß ist vollständig; die Zusammensetzung der Aminosäuren entspricht eher derjenigen unserer Muskeln 1, als die pflanzlicher Proteine.
Daher wird tierisches Protein hochwertiger als pflanzliches wahrgenommen, denn tierische Proteine schneiden besser in Qualitätsbewertungen ab (wie zum Beispiel beim Digestible Indispensable Amino Acid Score; DIAAS).
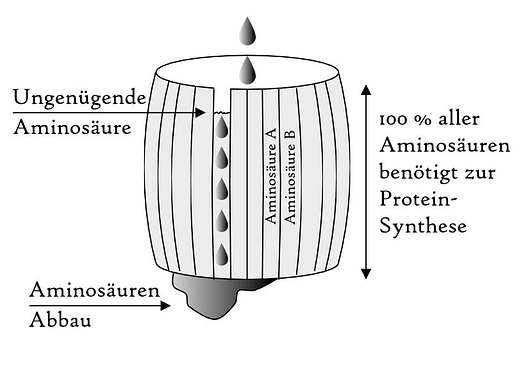
Darstellung des Liebigschen Gesetzes vom Minimum. Das Wachstum wird durch die knappste Ressource eingeschränkt, nicht durch die absolute Menge der verfügbaren Ressourcen. Daher kann schon eine Aminosäure in suboptimaler Konzentration die Proteinsynthese behindern.
Im Gegensatz zu vielen tierischen Proteinquellen wie Hühnchen, Schwein oder Eiern haben Getreide weniger der Aminosäure Lysin im Verhältnis zu anderen Aminosäuren, die sie enthalten 2; Hülsenfrüchte haben weniger Methionin.
Deshalb geht dieser Punkt an tierisches Eiweiß - in der Theorie.

Lysingehalt von pflanzlichen und tierischen Lebensmitteln. (Modifiziert nach van Vliet et al. 2015, doi: 10.3945/jn.114.204305).
Richten wir unseren Blick auf den Alltag, dann sehen wir: diese Bewertung hat wenig praktische Relevanz. Die Kombination von Getreide und Hülsenfrüchten (z. B. Brot mit Hummus) ergibt eine vollständige Aminosäure-Zusammensetzung. Die Kombination der Aminosäuren im Körper funktioniert sogar, wenn du morgens Brot isst und abends Hummus genießt.

Methioningehalt von pflanzlichen und tierischen Lebensmitteln. (Modifiziert nach van Vliet et al. 2015, doi: 10.3945/jn.114.204305)
Ein interessanter Gedanke in dieser Kateogorie: Pflanzliche Proteinquellen haben oft weniger Lysin, Methionin oder andere unentbehrliche Aminosäuren. Dafür besitzen sie mehr von anderen Aminosäuren, die bezogen auf Leistung und Gesundheit eine ebenfalls wichtige Rolle spielen.
So enthält Sojaprotein zwar nicht so viel Leuzin wie Molkeprotein („Whey“), es hat aber einen fast dreimal höheren Arginin-, einen 2-3 mal höheren Glutamin- und einen doppelt so hohen Glycingehalt.
Arginin ist wichtig für Gefäßerweiterung oder die Immunfunktion 3, Glutamin für schnell wachsende Zellen wie die des Immunsystems 4 und unser Kollagen bilden wir zu einem Drittel aus Glycin 5.
Der Gehalt dieser entbehrlichen oder bedingt unentbehrlichen Aminosäuren wird oft vergessen bei der Bewertung von Pflanzenproteinen; gerade Glycin kann unter Umständen nicht ausreichend von uns selbst für die Kollagenproduktion hergestellt werden 6.

Betrachtet man Proteine isoliert, dann gibt es innerhalb von pflanzlichen häufiger eine limitierende Aminosäure.
+ 1 Punkt tierisches Eiweiß
Anaboles Potenzial für den Muskelaufbau
Für das Muskelpotential verantwortlich sind nach heutigem Wissensstand hauptsächlich die unentbehrlichen Aminosäuren, mehr noch die verzweigtkettigen (BCAAs: Leuzin, Isoleuzin, Valin) und davon ganz besonders Leuzin - sie gilt als die anabolste Aminosäure 7 8. Daher spricht man tierischem Protein mehr anabole Kraft zu, wenn es isoliert betrachtet wird 9.
Tierisches Protein wie Molke besitzt viel BCAAs und Leuzin und wirkt anaboler in Untersuchungen, die kurze Zeiträume von einigen Tagen oder Wochen betrachten.Es gibt jedoch einige Belege dafür, dass die Einnahme einer gleichen Menge pflanzlicher Proteine, so wie Erbse oder Reis 10 11 12 13, zu demselben Anstieg von Kraft und Muskeln führt wie Molke, und das über Studienzeiträume von mehr als sechs Wochen.

Leuzingehalt von pflanzlichen und tierischen Lebensmitteln. (Modifiziert nach van Vliet et al. 2015, doi: 10.3945/jn.114.204305)
Im Fall einer Studie von wenigen Tagen oder Wochen wird häufig die akute Muskelproteinsynthese nach dem Training oder Essen untersucht, bei Studien die länger als 6 Wochen laufen kann der mittel- bis langfristige Muskelaufbau untersucht werden. Akuter und langfristiger Muskelaufbau sind zwei verschiedene Dinge, viel vom ersten muss nicht unbedingt viel vom zweiten bedeuten.
Nur weil die Proteinsynthese direkt nach dem Molkeproteinshake höher als beim Erbsenproteinshake ist, bedeutet das nicht, Whey führt langfristig zu mehr handfester Muskelmasse. Wenn es darum geht, welches Protein das größte Potential für Muskelaufbau hat, dann sollte das Protein mit den besten Langzeitaussichten gewinnen. Und in diesem Fall liegt der Vorteil nicht mehr klar auf Seiten des tierischen Proteins.
Denn laut aktueller Interventions- und Meta-Studien führt pflanzliches Protein über längere Zeiträume zum gleichen Muskelwachstum wie tierisches Protein 14 15 16.
Das zeigt, praktisch gesehen scheint es keinen Unterschied für den Muskelaufbau zu geben.

Weil die harten Muskeln mehr zählen, als ein theoretisches Konstrukt, gibt es hier ein Unentschieden.
Unentschieden
Leistung, Kraft und Ausdauer - Tierisches oder pflanzliches Eiweiß
Bei der sportlichen Leistung sieht es genauso wenig eindeutig aus. Zwar vergleichen immer mehr Studien tierisches oder pflanzliches Eiweiß in Bezug auf Leistung von Athleten, wie Muskelaufbau 17, Kraft oder Ausdauer 18.
Doch die wenigen handfesten Studien finden häufig keinen Unterschied zwischen tierischen und pflanzlichen Proteinquellen. Die Frage nach der sportlichen Leistung bleibt eine Herausforderung, vor allem für längere Untersuchungszeiträume, und wird in Zukunft ein wichtiges Forschungsfeld sein.
Sicher ist: Die vegane Ernährung kann die perfekte Basis bieten für sportliche Höchstleistungen. Sie optimiert die körperliche Leistungsfähigkeit weil sie das Immunsystem aufbaut und oxidativem Stress entgegenwirkt, sie deckt den Nähstoffbedarf und verbessert die Erholung und die Krankheitsresistenz von Sportlern 19.
Damit ist eine vegane Ernährung sehr gut geeignet um Leistung, Ausdauer, Durchhaltevermögen, Erholung, Regeneration und Immunabwehr von Athleten zu vermehren.

Aufgrund der dünnen Datenlage ein aufrechtes Unentschieden, wobei viele Punkte für die pflanzliche Ernährung sprechen.
Unentschieden
Verdaulichkeit des Proteins und enthaltener Nährstoffe
Ein Lebensmittel liefert neben Protein auch andere Nährstoffe. Sekundäre Pflanzenstoffe in pflanzlichen Lebensmitteln können die Verdaulichkeit verringern. Durch eine gehemmte Verdauung können weniger Aminosäuren aus dem Nahrungsbrei aufgenommen werden, als vorhanden sind. Den Rest scheidet der Körper aus.
Wenn wir unbehandelte pflanzliche mit tierischen Lebensmitteln vergleichen, haben tierische Lebensmittel eine höhere Verdaulichkeit. Sobald aber pflanzliche Lebensmittel entsprechend aufbereitet werden, über einweichen, kochen, keimen oder fermentieren, dann ist die Verdaulichkeit ähnlich. Ein Beispiel: Sojamehl rangiert bei einem Verdaulichkeitswert von 0,84, aufbereitetes Sojaprotein-Isolat bei 0,98. Bei der Aufbereitung wurden alle anderen Stoffe außer Protein entfernt.

Einfluss der Fermentation auf die Nährstoffverfügbarkeit. Die Fermentation bricht molekulare Bindungen auf und macht Nährstoffe wie Protein, Eisen oder Kalzium besser verfügbar. (Modifiziert nach Nkhata et al. 2018, doi: 10.1002/fsn3.846).
Auch hier gibt es, wie bei der anabolen Wirkung von tierischem Eiweiß, zwei Seiten des Burgerpatties. Sekundäre Pflanzenstoffe sind essentiell für unsere Gesundheit 20 und viele davon machen die pflanzenbasierte Ernährung erst zu dem was sie ist - die gesündeste Ernährung von allen.
Dennoch geht der Punkt an tierische Eiweiße, auch wenn pflanzliche Proteinquellen nach richtiger Vor- und Zubereitung ähnliche Verdaulichkeiten wie tierische aufweisen. Niemand isst Bohnen ungekocht. Es ist aber fraglich ob jeder immer lange genug einweicht und kocht oder keimen lässt, damit die Hemmstoffe bestmöglich reduziert werden. Weil tierisches Protein in dieser Hinsicht keinen Extraschritt braucht, bekommt es den Punkt.

Die für isolierte Proteine ermittelte Verdaulichkeit ist höher für die meisten tierischen Proteine.
+ 1 Punkt tierisches Eiweiß
Tierische Eiweiße, Saures und Basisches
Tierische Eiweiße haben im Vergleich zu pflanzlichen ein höheres Natrium-zu-Kalium-Verhältnis, weniger Magnesium im Vergleich zu Kalzium und ein ungünstiges Verhältnis der schwefelhaltigen Aminosäuren Methionin zu Cystein.
Für pflanzliches Protein gilt das Gegenteil. Es enthält mehr Kalium, weniger Natrium, mehr Magnesium, weniger Kalzium und ein Methionin-zu-Cystein-Verhältnis, das dem der menschlichen Muttermilch ähnlicher ist. Kuhmilch hingegen ist ein tierisches Protein und enthält dreimal so viel Methionin wie Cystein.
Diese Unterschiede führen zu einer höheren Säurelast durch tierische Lebensmittel 21. Und das kann man ganz pauschal so sagen, denn das trifft so gut wie immer zu. Die ernährungsbedingte, latente, metabolische Azidose existiert als Konzept schon lange und wird von der Forschung aktuell vermehrt aufgegriffen und bestätigt 22.

Das Verhältnis von pflanzlichen zu tierischen Lebensmitteln bestimmt die Säurebelastung. Die Säurebelastung steigt mit dem Verzehr von mehr tierischen Lebensmitteln. (Modifiziert nach Ströhle et al. 2010, doi: 10.3945/ajcn.2009.28637).
Eine tierlastige Ernährung und besonders tierisches Protein verschieben den pH-Wert des Blutes an die untere Grenze des Normbereichs. Mehr und mehr Forschung belegt, dass diese Veränderung durch zu viel Tierisches weitreichende Konsequenzen für Knochengesundheit, Muskelwachstum oder Immunfunktion haben kann.
Versauerung erhöht die Ausschüttung des Stresshormons Kortisol 23, stört die Wirkung des Wachstumshormons (HGH) 24. und führt zu mehr Muskelverlust bei zu wenig Bewegung.
Pflanzliche Proteine sind schonender für die Entgiftungsorgane Niere, Leber und für den gesamten Organismus.

Eiweiß wirkt immer sauer, aber pflanzliches weniger als tierisches
+ 1 Punkt pflanzliches Eiweiß
Verursacht tierisches Eiweiß Krebs?
Das Risiko für Krebs wird von mehreren Faktoren beeinflusst: der genetischen Veranlagung und Umwelteinflüssen wie Ernährungs- und anderen Lebensgewohnheiten. Ein übermäßig zum Aufbau neigender Stoffwechsel (anaboler Stoffwechsel), wie er durch tierisches Protein verstärkt wird, könnte zu einem höheren Krebsrisiko beitragen 25.
Aufgrund seiner anabolen Eigenschaften hat tierisches Eiweiss, wie das aus der Milch, einen starken Einfluss auf die Ausschüttung von Insulin und anderen Wachstumsfaktoren (z. B. IGF-1 oder micro-RNA) 26. Solche Botenstoffe unterstützen Zellwachstum von guten aber auch schlechten Zellen 27. Ein übertriebenes Signal für Wachstum kann die Entstehung von Krebs fördern 28 29. Diese Eigenschaften können tierisches Eiweiß generell problematischer für die Gesundheit machen 30 31 32.
Die WHO beschreibt in der Bewertung "Carcinogenic effect of eating red meat and processed meat" 33, warum Fleisch und verarbeitetes Fleisch krebserregend sein können. Es besteht ein enger Zusammenhang zwischen dem Verzehr von rotem Fleisch, der Ammoniakproduktion im Dickdarm und einem erhöhten Darmkrebsrisiko 34. Dagegen kann der Austausch von tierischem durch pflanzliche Proteine eine Strategie sein, um das Risiko für Darmkrebs bei Personen mit bestimmten Fettsäurestoffwechsel-Genvarianten zu senken 35.
Im Bezug auf Leberkarzinome kommt eine aktuelle Studie zum Ergebnis, dass pflanzenbasierte low carb Ernährung das Risiko minimiert, ganz im Unterschied zu low carb mit tierischen Lebensmitteln 36.
Auch in diesem Feld sind die Ergebnisse meist nicht eindeutig und es ist schwer, Umwelt, Lebensstil und Ernährung so aufzudröseln, um das Risiko für Krebs nur einem Nahrungsbestandteil wie tierischem Protein zuzuschreiben. Dennoch gibt es Hinweise, dass tierisches Protein mit der Entstehung von manchen Krebsarten in Verbindung steht.
Für pflanzliches Protein gilt eher das Gegenteil: es gibt Hinweise dass viele sekundäre Pflanzenstoffe krebs- oder tumorbekämpfend wirken, so wie Kurkumin oder Lektine 37 38.

Wo pflanzliches Eiweiß Krebs vorbeugen kann, erhöht tierisches Eiweiß das Risiko für manche Krebserkrankungen.
+ 1 Punkt pflanzliches Eiweiß
Insulinresistenz und metabolisches Syndrom
Der glykämische Index beleuchtet, wieviel Blutzucker durch den Verzehr eines bestimmten Nahrungsmittels im Blut auftaucht. Da das abhängig von Kohlenhydraten ist, werden einzig pflanzliche Lebensmittel gemessen, denn nur sie enthalten Kohlenhydrate. Es ist aber falsch, sich bezüglich der Wirkung auf die Gesundheit nur auf den Blutzucker zu verlassen.
Mindestens genau so wichtig und gesundheitlich relevant ist die Ausschüttung von Insulin.
Proteinreiche tierische Lebensmittel wie Fisch, Rindfleisch oder Käse enthalten kaum oder keine Kohlenhydrate. Dennoch haben sie einen ähnlichen Insulin-Index wie die pflanzlichen Proteinquellen Linsen, Nudeln oder brauner Reis. Gramm für Gramm führen Rindfleisch oder Käse sogar zu einer höheren Insulinproduktion im Körper als brauner Reis oder Linsen 39.
Da eine überhöhte Insulinproduktion zu Herz-Kreislauf-Erkrankungen führen kann, ist tierisches Eiweiß in dieser Hinsicht kritischer als pflanzliches 40. Obwohl fettleibige Patienten in einer Studie durch eine Diät mit hohem tierischem Eiweißanteil Gewicht verlieren konnten, verbesserte sich ihre Insulinsensitivität nach der Gewichtsabnahme nicht. Zudem wird zu viel tierisches Protein aufgrund seiner insulinogenen Wirkung mit einem höheren Risiko für Schwangerschaftsdiabetes in Verbindung gebracht.
Nicht nur verarbeitete Kohlenhydrate sondern besonders tierische Proteine führen zu einer starken Insulin-Antwort. Sehr eindeutig sieht das bei der Entstehung von Insulinresistenz und dessen Begleiterscheinung aus, dem metabolischen Syndrom.
Ein hoher BCAA-Blutspiegel, den Aminosäuren Leuzin, Isoleuzin und Valin, die vermehrt in tierischen Proteinen vorkommen, steht in Zusammenhang mit erhöhten Insulinleveln und Insulinresistenz 41 42.
Insulinresistenz ist ein Risikofaktor für viele Folgeerkrankungen und tierisches Protein zu konsumieren verstärkt die Insulinresistenz und fördert damit das Risiko für Diabetes, Herz-Kreislauf-Erkrankungen und Nierenversagen. Der Verzehr von pflanzlichem Protein wirkt dagegen schützend gegen die Entwicklung von Gefäßerkrankungen 43.

Tierisches Protein aus Steak führt zu stärkerer Insulinausschüttung als ein Teller Pasta al-dente. Pflanzliche Proteine werden empfohlen, um die Insulinsensitivität zu erhöhen.
+ 1 Punkt pflanzliches Eiweiß
Unterschied pflanzliche und tierische Eiweiße für Diabetes
Während tierische Eiweiße die Insulinresistenz erhöhen 44, steigert pflanzliches Eiweiß die Insulinsensitivität 45 46. Die Wirkung auf Insulin ist ein Grund, warum tierisches Eiweiß ungesund wirkt und das Risiko für Diabetes mehr als verdoppeln kann 47 48. Im Gegensatz dazu kann pflanzliches Eiweiß das Diabetes-Risiko senken 49, und immer mehr Ärzte empfehlen eine pflanzliche Ernährung zur Behandlung von Diabetes 50 51 52.
Wenn Teilnehmer einer Untersuchung nur 5 % der Nahrungsenergie aus tierischem Eiweiß durch pflanzliches Eiweiß ersetzten, war das mit einem um 23 % verringerten Risiko für Typ-2-Diabetes verbunden 53.

Weniger Diabetes durch weniger tierisches Protein.
+ 1 Punkt pflanzliches Eiweiß
Gewichtszunahme durch tierische Proteine
Pflanzliches für tierisches Eiweiß kann das Risiko für Übergewicht bei Jugendlichen senken 54. Der oben erwähnte Insulin-Effekt trägt wahrscheinlich dazu bei, dass tierisches Eiweiß mit einer Gewichtszunahme 55 und einem höheren Body-Mass-Index 56 assoziiert ist. Besonders Milchprotein zeigt Verbindungen zu erhöhten Blutlevels von BCAAs, Wachstumshormon und IGF1 57 - alles Regulatoren für Wachstum und Zunahme. Das alles war zu erwarten: Milch ist dazu da Säuglinge der eigenen Spezies schnell wachsen zu lassen 58.
Im Gegensatz dazu führt die Aufnahme von pflanzlichem Eiweiß zu einem ausgeglichenen BMI. Mit pflanzlichem Eiweiß kann man einer Insulinresistenz, einem gestörten Fettstoffwechsel und damit Übergewicht vorbeugen 59 60.
In der Food4Me Studie mit 2400 Europäern hatten diejenigen Teilnehmer den höchsten BMI, die am meisten tierisches und am wenigsten pflanzliches Eiweiß aßen. Schon der Austausch von 1 % tierischem gegen pflanzliches Eiweiß konnte das Risiko für Übergewicht reduzieren 61 62.
Auch in Interventionsstudien konnte konsistent gezeigt werden, dass eine pflanzenbasierte Ernährung oder pflanzliches Eiweiß zur Normalisierung des BMI beiträgt und Übergewicht minimiert 63 64. Potentielle Gründe dafür sind die Assoziation von BCAAs wie Leuzin mit Fettmasse oder die unterschiedliche Ausschüttung von Verdauungshormonen - pflanzliches Protein sättigt vermutlich einfach nachhaltiger 65.
Manche Pflanzenproteine wie Soja sind besonders gut darin, subkutanes Fett und Hüftumfang zu reduzieren 66.

Pflanzliches Eiweiß sorgt für einen ausgeglichenen BMI.
+ 1 Punkt pflanzliches Eiweiß
Herz-Kreislauf-Gesundheit
Herz-Kreislauf-Erkrankungen wie Herzinfarkt oder Schlaganfall sind die Todesursache Nummer eins in vielen westlichen Gesellschaften - ihr Vorkommen ist in den letzten 40 Jahren explodiert.
Ein Grund dafür könnte der maßlose Konsum von tierischem Protein sein. Tierisches Protein ist mit höherem Risiko für Herzinsuffizienz 67 und Herzerkrankungen 68 69 verbunden, pflanzliches Eiweiß mit einem geringeren.

Auswirkung von zwei verschiedenen Proteinquellen mit unterschiedlichem Phytinsäuregehalt auf die Cholesterinkonzentration im Blut von Schweinen. Lupinenprotein mit einem höheren Gehalt an Phytinsäure senkte den Cholesterinspiegel im Blut nach vier Wochen cholesterinreicher Ernährung. Phytinsäure verringerte die Cholesterin-Aufnahme der Zellen. (Modifiziert nach Radtke et al. 2014, doi: 10.1186/1743-7075-11-9).
Tierisches Eiweiß kann den Cholesterinspiegel im Blut erhöhen 70 71, pflanzliches Eiweiß wirkt neutral bzw. senkt den Cholesterinspiegel 72 73 74. Man kann Risikofaktoren für Herz-Kreislauf-Erkrankungen minimieren, wie LDL- und Gesamtcholesterin, indem man tierisches Eiweiß durch pflanzliches Eiweiß ersetzt 75 76.

Pflanzliches Protein für tierisches verringert Risiko für Herz-Kreislauf-Erkrankungen.
+ 1 Punkt pflanzliches Eiweiß
Sterblichkeit - Tierisches Eiweiß ungesund?
Ähnlich sieht es aus bei der Gesamtsterblichkeit 77 78. Weniger tierisches Eiweiß zu konsumieren kann ebenso lebensverlängernd wirken, wie insgesamt weniger zu essen 79 80 81.
Menschen, die ihren Proteinbedarf hauptsächlich mit Hülsenfrüchten decken, leben überdurchschnittlich lange 82 83, im Gegensatz zu Menschen, die ihren Proteinbedarf hauptsächlich aus tierischen Quellen decken.
Eine Studie, die mehr als 600 000 Menschen über einen Zeitraum von 16 Jahren verfolgte, zeigte, dass der Austausch von nur 3 % des tierischen Proteins gegen pflanzliche Proteine die Sterblichkeit um 10 % reduzierte 84.
Eine andere aktuelle Metastudie bestätigte, dass der Ersatz von tierischem durch pflanzliches Eiweiß vorteilhaft für die Langlebigkeit und die Sterblichkeit ist 85.

Mit pflanzlichem Protein lebt man länger und bleibt länger gesund.
+ 1 Punkt pflanzliches Eiweiß
Tierisches Eiweiß belastet das Klima
Tiere haben eine schlechte Umwandlungseffizienz des Futters. Das Ergebnis der Vorverdauung des pflanzlichen Proteins ist ein immenser Energieverlust. Von 100 Kalorien, die das Tier frisst, erreichen uns Menschen je nach Tier nur drei bis acht Kalorien 86. Der menschliche Verzehr von überwiegend tierischem Eiweiß führt zu einem massiven Bedarf an Ackerland und Futtermitteln und letztlich zur Abholzung der Regenwälder 87.
Die Nachfrage nach tierischem Eiweiß erhöht somit auch Treibhausgasemissionen. Allein die Produktion von Rindfleisch ist für unglaubliche 36 % der Treibhausgasemissionen des gesamten Lebensmittelsektors in den USA verantwortlich 88.
Folgen des Verzehrs von tierischem Eiweiß sind die Abholzung von Wäldern, ein beispielloses Massensterben in der Natur, die Verschwendung von Süßwasser und die Verschmutzung der Umwelt.
Die vom Menschen verursachte Zerstörung geschieht in einem so gewaltigen Ausmaß, dass wir - so wie der große Asteroid damals für das fünfte - der Grund für das sechste Massensterben auf der Erde sind 89. Unsere aktuellen Aussterbe-Raten sind laut Weltnaturschutzunion 1.000- bis 10.000-fach höher als normalerweise 90.
Fatal für uns: nur zwei der Top-10 Proteinquellen in USA sind rein pflanzlich 91, das dürfte in Deutschland nicht anders sein.

Eine Ernährung ohne tierisches Eiweiß ist am besten für die Erde.
+ 1 Punkt pflanzliches Eiweiß
Ethische Fragen bezüglich der Behandlung von Tieren
Es ist offensichtlich dass dieser Punkt nur an pflanzliches Eiweiß gehen kann. Ethisch unbedenkliche Herstellung von tierischen Nahrungsmitteln ist in unserer Gesellschaft nicht möglich; jedes Produkt aus der Tierindustrie ist an Leid geknüpft.
Aussagen wie „Vegansein würde mehr Tiere töten weil der Mähdrescher auf dem Feld welche erwischt“ oder „Pflanzen haben auch Gefühle“ sind daneben und schlicht falsch. Wie schon erwähnt müssen wir durch die schlechte Verwertungseffizienz der Tiere viel mehr Futterpflanzen anbauen als eigentlich für den menschlichen Bedarf nötig: mehr tierische Eiweiße bedeuten mehr benötigter Platz für Felder. Und auch wenn wir nicht hineinschauen können: die biologischen Voraussetzungen um Schmerz zu spüren sind bei Pflanzen nicht gegeben.

Tierisches Protein ist ethisch nicht vertretbar.
+ 1 Punkt pflanzliches Eiweiß
Bessere Nierengesundheit durch tierisches oder pflanzliches Eiweiß?
Neuere epidemiologische Erkenntnisse zeigen, dass nicht nur die Menge sondern auch die Herkunft des Proteins ein Faktor für die Nierenfunktion ist. Für die Nierengesundheit macht es einen Unterschied ob das Eiweiß pflanzlichen oder tierischen Ursprungs ist.
Gesundheitlich gesehen fordern schwefelhaltige Aminosäuren (Cystein, Homocystein, Methionin, Taurin) die Nieren am meisten heraus. Diese Schwefelverbindungen haben eine saure Wirkung auf den Körper und die Nieren helfen uns das Gleichgewicht zu halten – sie entsorgen die überschüssigen sauren Bestandteile und scheiden dafür Ammoniak aus 92.
Diese mechanistische Vermutung wurde durch aktuelle, große epidemiologische Untersuchungen bestätigt. Zehn Jahre Beobachtung der Teilnehmer zeigte, dass die Nierenleistung weniger abnimmt mit pflanzlichem Protein, im Vergleich zu tierischem 93. Generell ist klar, dass die Säurebelastung der Nieren zu einer Abnutzung und höherem Krankheitsrisiko führt 94.
In mehreren Langzeitstudien wurde eine erhöhte Filtrationsrate und Hyperfiltration bei tierischem Eiweiß im Vergleich zu pflanzlichem Eiweiß beobachtet. Eine erhöhte Filtrationsrate trägt zur Nierenschädigung bei und ist ein Indikator für den negativen Einfluss der Ernährung auf die Nierenfunktion 95 96 97 98.
Darüber hinaus gibt es einen positiven synergistischen Effekt von Pflanzenprotein und anderen pflanzlichen Nahrungsmolekülen auf die Nierenfunktion. So enthalten Soja- oder Reisprotein besondere Aminosäuren oder Verbindungen wie Isoflavone, die in Zusammenhang mit Nierenschutz, verbesserter Nierendurchblutung und weniger systemischen Entzündungen stehen 99 100.
Die Amerikanische Nierenstiftung empfiehlt eine Ernährung mit pflanzlichen Proteinen, um die Nierengesundheit zu unterstützen 101. Autoren einer aktuellen Studie empfehlen eine solche Ernährung besonders für Patienten mit chronischer Nierenerkrankung 102.
Eine pflanzliche Ernährung bietet daher gute Chancen, die Nieren gesund zu halten und bestehende Nierenerkrankungen zu bekämpfen 103.

Wenn es um Nierengesundheit geht, steht pflanzliches vor tierischem Protein.
+ 1 Punkt pflanzliches Eiweiß
Begleitstoffe - Verhältnis von günstigen zu ungünstigen Inhaltsstoffen
Eiweiß kommt im Gesamtpaket als Lebensmittel in einer sogenannten Nahrungsmatrix. Im tierischen Fall enthält diese Nahrungsmatrix in der Regel viel gesättigtes Fett, Cholesterin und andere Stoffe tierischen Ursprungs. Die Folge: Wenn man viel tierisches Eiweiss isst, dann nimmt man viel gesättigtes Fett, Cholesterin und andere Risikofaktoren für Zivilisationskrankheiten zu sich 104. Damit ist der Zusammenhang von Eiweiß und ungesund natürlich nicht mehr weit.
Wenn tierisches Eiweiß bezogen auf die gesundheitlichen Vorteile der Nahrungsmatrix der Klassenclown ist, dann ist pflanzliches Eiweiß der Klassenprimus. Wer auf Eiweiß aus rein pflanzlichen Quellen setzt, hat komplette Nährstoffpakete, die gut für die Gesundheit sind 105.
So versorgen pflanzliche Proteine besonders gut mit Kalium, Magnesium oder Folsäure. Wer viele pflanzliche Proteine zu sich nimmt, wird aufgrund der hohen Nährstoffdichte automatisch hervorragend versorgt. Diesen von Wissenschaftlern entdeckten Zusammenhang von Eiweiß und gesunder Ernährung gibt es bei tierischem Eiweiß nicht 106.

Der Konsum von pflanzlichem Protein ist mit ausreichender Nährstoffversorgung Verbunden.
+ 1 Punkt pflanzliches Eiweiß
Ein klares Ergebnis: Pflanzliche besser als tierische Eiweiße
Jetzt weißt du, wie pflanzliches Eiweiß und tierisches Eiweiß im Vergleich stehen.

11 Punkte für pflanzliches Eiweiß
2 Punkte für tierisches Eiweiß
Es gibt drei Kategorien, in denen pflanzliches Eiweiß auf den ersten Blick schlechter dasteht als tierisches: Verdaulichkeit, Aminosäurezusammensetzung und anaboles Potenzial.
Auf den zweiten Blick verschwimmen die Unterschiede in diesen Bereichen, weil man diese günstigen Eigenschaften auch aus pflanzlichem Eiweiß erhalten kann, allerdings ohne Nachteile für die Gesundheit, Ethik und Umwelt.
Es gibt drei Strategien, um das Potential durch den Konsum von pflanzlichem Eiweiß vollständig über das von tierischem Eiweiß zu heben.
Diese Strategien sind:
- 1Proteinmenge anpassen (> 1,2 g Protein je Kilo Körpergewicht und Tag)
- 2Verdaulichkeit verbessern (einweichen und kochen)
- 3Lebensmittel kombinieren (über den ganzen Tag)
Wenn man diese Prinzipien umsetzt, dann gibt es wenig Grund weiterhin auf tierisches Protein zu setzen. Einzig die Gewohnheit diktiert vielen den Geschmack und den „echten“ Burger. Nicht tierisches Eiweiß sondern pflanzliches zu nutzen, hat Vorteile für die Gesundheit, Umwelt und Mitmenschen. Dabei muss es nicht unbedingt die Ernährung ohne tierisches Eiweiß sein. Wie viele Untersuchungen und immer mehr Flexitarier belegen, kann schon der gelegentliche Austausch von tierisch gegen pflanzlich große Vorteile bringen.
Kostenlose Broschüre!
Vorurteile gegen pflanzliches Protein sabotieren die Ernährung vieler Menschen. Entdecke, wie dich Süßstoffe oder verarbeitete Lebensmittel sabotieren können - und was du dagegen tun kannst.

Quellenverzeichnis
- Food and Agriculture Organization of the United Nations. (1981). Amino-acid content of foods and biological data on proteins.[↩]
- Young, V. R., & Pellett, P. L. (1994). Plant proteins in relation to human and amino acid nutrition. Am J Clin Nutr, 59(suppl), 1203S-12S.[↩]
- Wu, G., & Morris, M. (1998). Arginine metabolism: nitric oxide and beyond. Biochemical Journal, 336, 1–17.[↩]
- Wu, G. (2009). Amino acids: Metabolism, functions, and nutrition. Amino Acids, 37(1), 1–17.[↩]
- Li, P., & Wu, G. (2018). Roles of dietary glycine, proline, and hydroxyproline in collagen synthesis and animal growth. Amino Acids, 50(1), 29–38.[↩]
- Meléndez-Hevia, E., De Paz-Lugo, P., Cornish-Bowden, A., & Cárdenas, M. L. (2009). A weak link in metabolism: the metabolic capacity for glycine biosynthesis does not satisfy the need for collagen synthesis. Journal of Biosciences, 34(6), 853–872.[↩]
- Lynch, C. J., Halle, B., Fujii, H., Vary, T. C., Wallin, R., Damuni, Z., & Hutson, S. M. (2003). Potential role of leucine metabolism in the leucine-signaling pathway involving mTOR. American Journal of Physiology - Endocrinology and Metabolism, 285(4 48-4).[↩]
- Anthony, J. C., Anthony, T. G., Kimball, S. R., Vary, T. C., & Jefferson, L. S. (2000). Orally administered leucine stimulates protein synthesis in skeletal muscle of postabsorptive rats in association with increased elF4F formation. Journal of Nutrition, 130(2), 139–145.[↩]
- Van Loon, L. J. C. (2012). Leucine as a pharmaconutrient in health and disease. Current Opinion in Clinical Nutrition and Metabolic Care, 15(1), 71–77.[↩]
- Banaszek, A., Townsend, J. R., Bender, D., Vantrease, W. C., Marshall, A. C., & Johnson, K. D. (2019). The Effects of whey vs. pea protein on physical adaptations following 8-Weeks of high-intensity functional training (HIFT): a pilot study. Sports, 7(1), 12.[↩]
- Kalman, D., Escalante, A., Hewlings, S. J., & Willoughby, D. S. (2018). The body composition effects of extra protein in elite mixed martial artists undergoing frequent training over a six-week period. EC Nutrition, 13(6), 396–401.[↩]
- Babault, N., Christos Païzis, Deley, G., Laetitia Guérin-Deremaux, Marie-Hélène Saniez, Lefranc-Millot, C., & Allaert, F. A. (2015). Pea proteins oral supplementation promotes muscle thickness gains during resistance training: A double-blind, randomized, Placebo-controlled clinical trial vs. Whey protein. Journal of the International Society of Sports Nutrition, 12(1), 1–9.[↩]
- Joy, J. M., Lowery, R. P., Wilson, J. M., Purpura, M., De Souza, E. O., Wilson, S. M., Kalman, D. S., Dudeck, J. E., & Jäger, R. (2013). The effects of 8 weeks of whey or rice protein supplementation on body composition and exercise performance. Nutrition Journal, 12(1), 1–7.[↩]
- Hevia-Larraín, V., Gualano, B., Longobardi, S. G., Fernandes, A. L., Costa, L. A. R., Pereira, R. M. R., Artioli, G. G., Phillips, S. M., & Roschel, H. (2021). High-Protein Plant-Based Diet Versus a Protein-Matched Omnivorous Diet to Support Resistance Training Adaptations: A Comparison Between Habitual Vegans and Omnivores. Sports Medicine.[↩]
- Pinckaers, P. J. M., Kouw, I. W. K., Hendriks, F. K., van Kranenburg, J. M. X., de Groot, L. C. P. G. M., Verdijk, L. B., Snijders, T., & van Loon, L. J. C. (2021). No differences in muscle protein synthesis rates following ingestion of wheat protein, milk protein, and their protein blend in healthy, young males. British Journal of Nutrition.[↩]
- Messina, M., Lynch, H., Dickinson, J. M., & Reed, K. E. (2018). No difference between the effects of supplementing with soy protein versus animal protein on gains in muscle mass and strength in response to resistance exercise. International Journal of Sport Nutrition and Exercise Metabolism, 38(6), 674–685.[↩]
- Lynch, H. M., Buman, M. P., Dickinson, J. M., Ransdell, L. B., Johnston, C. S., & Wharton, C. M. (2020). No significant differences in muscle growth and strength development when consuming soy and whey protein supplements matched for leucine following a 12 week resistance training program in men and women: A randomized trial. International Journal of Environmental Research and Public Health, 17(11).[↩]
- Boutros, G. H., Landry-Duval, M. A., Garzon, M., & Karelis, A. D. (2020). Is a vegan diet detrimental to endurance and muscle strength? European Journal of Clinical Nutrition, 74, 1550–1555.[↩]
- Wirnitzer, K. C. (2020). Vegan Diet in Sports and Exercise – Health Benefits and Advantages to Athletes and Physically Active People: A Narrative Review. International Journal of Sports and Exercise Medicine.[↩]
- Petroski, W., & Minich, D. M. (2020). Is there such a thing as “anti-nutrients”? A narrative review of perceived problematic plant compounds. Nutrients, 12(10), 1–32.[↩]
- Remer, T., & Manz, F. (1995). Potential renal acid load of foods and its influence on urine pH. In Journal of the American Dietetic Association (Vol. 95, Issue 7, pp. 791–797).[↩]
- Pizzorno, J. (2015). Acidosis: an old idea validated by new research. Integrative Medicine (Boulder), 14(1), 8–12.[↩]
- Maurer, M., Riesen, W., Muser, J., Hulter, H. N., & Krapf, R. (2003). Neutralization of Western diet inhibits bone resorption independently of K intake and reduces cortisol secretion in humans. American Journal of Physiology - Renal Physiology, 284(1 53-1), 32–40.[↩]
- Green, J., & Maor, G. (2000). Effect of metabolic acidosis on the growth hormone/IGF-I endocrine axis in skeletal growth centers. Kidney International, 57(6), 2258–2267[↩]
- Melnik, B. C., John, S. M., Carrera-Bastos, P., & Cordain, L. (2012). The impact of cow’s milk-mediated mTORC1-signaling in the initiation and progression of prostate cancer. Nutrition and Metabolism, 9(1), 1. Nutrition & Metabolism[↩]
- Levine, M. E., Suarez, J. A., Brandhorst, S., Balasubramanian, P., Cheng, C. W., Madia, F., Fontana, L., Mirisola, M. G., Guevara-Aguirre, J., Wan, J., Passarino, G., Kennedy, B. K., Wei, M., Cohen, P., Crimmins, E. M., & Longo, V. D. (2014). Low protein intake is associated with a major reduction in IGF-1, cancer, and overall mortality in the 65 and younger but not older population. Cell Metabolism, 19(3), 407–417.[↩]
- Samani, A. A., Yakar, S., LeRoith, D., & Brodt, P. (2007). The role of the IGF system in cancer growth and metastasis: Overview and recent insights. Endocrine Reviews, 28(1), 20–47.[↩]
- Norat, T., Dossus, L., Rinaldi, S., Overvad, K., Grønbæk, H., Tjønneland, A., Olsen, A., Boutron-ruault, M. C., Boeing, H., Lahmann, P. H., Linseisen, J., Nagel, G., Trichopoulou, A., Trichopoulos, D., Kalapothaki, V., Sieri, S., Palli, D., & Panico, S. (2007). Diet, serum insulin-like growth factor-I and IGF-binding protein-3 in European women. European Journal of Clinical Nutrition, 61, 91–98.[↩]
- Ganmaa, D., Li, X. M., Wang, J., Qin, L. Q., Wang, P. Y., & Sato, A. (2002). Incidence and mortality of testicular and prostatic cancers in relation to world dietary practices. International Journal of Cancer, 98(2), 262–267.[↩]
- Holeček, M. (2018). Branched-chain amino acids in health and disease: metabolism, alterations in blood plasma, and as supplements. Nutrition and Metabolism, 15(1), 1–12.[↩]
- Melnik, B. C., Schmitz, G., John, S. M., Carrera-Bastos, P., Lindeberg, S., & Cordain, L. (2013). Metabolic effects of milk protein intake strongly depend on pre-existing metabolic and exercise status. Nutrition & Metabolism, 10, 1–6.[↩]
- Melnik, B. C. (2012). Excessive leucine-mTORC1-signalling of cow milk-based infant formula: the missing link to understand early childhood obesity. Journal of Obesity, 2012, 1–14.[↩]
- WHO. (2015). Q&A on the carcinogenicity of the consumption of red meat and processed meat. https://www.who.int/features/qa/cancer-red-meat/en/[↩]
- Møller, G., Andersen, J. R., Jalo, E., Ritz, C., Brand-Miller, J., Larsen, T. M., Silvestre, M. P., Fogelholm, M., Poppitt, S. D., Raben, A., & Dragsted, L. O. (2020). The association of dietary animal and plant protein with putative risk markers of colorectal cancer in overweight pre-diabetic individuals during a weight-reducing programme: a preview sub-study. European Journal of Nutrition, 59(4), 1517–1527.[↩]
- Andersen, V., Halekoh, U., Tjønneland, A., Vogel, U., & Kopp, T. I. (2019). Intake of red and processed meat, use of non-steroid anti-inflammatory drugs, genetic variants and risk of colorectal cancer: A prospective study of the danish “diet, cancer and health” cohort. International Journal of Molecular Sciences, 20(5).[↩]
- Liu, Y., Yang, W., VoPham, T., Ma, Y., Simon, T. G., Gao, X., Chan, A. T., Meyerhardt, J. A., Giovannucci, E. L., & Zhang, X. (2021). Plant-Based and Animal-Based Low-Carbohydrate Diets and Risk of Hepatocellular Carcinoma Among US Men and Women. Hepatology, 73(1), 175–185.[↩]
- Seca, A. M. L., & Pinto, D. C. G. A. (2018). Plant secondary metabolites as anticancer agents: Successes in clinical trials and therapeutic application. International Journal of Molecular Sciences, 19(1).[↩]
- Liu, Z., Luo, Y., Zhou, T. T., & Zhang, W. Z. (2013). Could plant lectins become promising anti-tumour drugs for causing autophagic cell death? Cell Proliferation, 46(5), 509–515.[↩]
- Holt, S. H. A., Brand Miller, J. C., & Petocz, P. (1997). An insulin index of foods: the insulin demand generated by 1000-kJ portions of common foods. American Journal of Clinical Nutrition, 66, 1264–1276.[↩]
- Després, J. P., Lamarche, B., Mauriège, P., Cantin, B., Dagenais, G. R., Moorjani, S., & Lupien, P. J. (1996). Hyperinsulinemia as an independent risk factor for ischemic heart disease. New England Journal of Medicine, 334(15), 952–957.[↩]
- Simonson, M., Boirie, Y., & Guillet, C. (2020). Protein, amino acids and obesity treatment. Reviews in Endocrine and Metabolic Disorders, 21(3), 341–353.[↩]
- Nilsson, M., Stenberg, M., Frid, A. H., Holst, J. J., & Björck, I. M. E. (2004). Glycemia and insulinemia in healthy subjects after lactose-equivalent meals of milk and other food proteins: The role of plasma amino acids and incretins. American Journal of Clinical Nutrition, 80(5), 1246–1253.[↩]
- Adeva-Andany, M. M., Ameneiros-Rodríguez, E., Fernández-Fernández, C., Domínguez-Montero, A., & Funcasta-Calderón, R. (2019). Insulin resistance is associated with subclinical vascular disease in humans. World Journal of Diabetes, 10(2), 63–77.[↩]
- Chen, Z., Zuurmond, M. G., van der Schaft, N., Nano, J., Wijnhoven, H. A. H., Ikram, M. A., Franco, O. H., & Voortman, T. (2018). Plant versus animal based diets and insulin resistance, prediabetes and type 2 diabetes: the Rotterdam Study. European Journal of Epidemiology, 33(9), 883–893.[↩]
- Azemati, B., Rajaram, S., Jaceldo-Siegl, K., Sabate, J., Shavlik, D., Fraser, G. E., & Haddad, E. H. (2017). Animal-protein intake is associated with insulin resistance in Adventist Health Study 2 (AHS-2) calibration substudy participants: A cross- sectional analysis. Current Developments in Nutrition, 1(4), 1–7.[↩]
- Hung, C.-J., Huang, P.-C., Li, Y.-H., Lu, S.-C., Ho, L.-T., & Chou, H.-F. (2006). Taiwanese vegetarians have higher insulin sensitivity than omnivores. British Journal of Nutrition, 95(1), 129–135.[↩]
- Wang, T. J., Larson, M. G., Vasan, R. S., Cheng, S., Rhee, E. F., McCabe, El., Lewis, G. D., Fox, C. S., Jacques, P. F., & Fernandez, C. (2011). Metabolite profiles and the risk of developing diabetes. Nature Medicine, 17(4), 448–453.[↩]
- Sluijs, I., Beulens, J. W. J., van der A, D. L., Spijkerman, A. M., Grobbee, D. E., & van der Schouw, Y. T. (2010). Dietary intake of total, animal, and vegetable protein and risk of type 2 diabetes in the European Prospective (EPIC)-NL Study. Diabetes Care, 33(1), 1–6.[↩]
- Pan, A., Sun, Q., Bernstein, A. M., Schulze, M. B., Manson, J. E., Willett, W. C., & Hu, F. B. (2011). Red meat consumption and risk of type 2 diabetes: 3 cohorts of US adults and an updated meta-analysis. American Journal of Clinical Nutrition, 94, 1088–1096.[↩]
- Tonstad, S., & Clifton, P. (2017). Vegetarian diets and the risk of type 2 diabetes. Vegetarian and Plant-Based Diets in Health and Disease Prevention, 18(101), 355–367.[↩]
- De Koning, L., Fung, T. T., Liao, X., Chiuve, S. E., Rimm, E. B., Willett, W. C., Spiegelman, D., & Hu, F. B. (2011). Low-carbohydrate diet scores and risk of type 2 diabetes in men. American Journal of Clinical Nutrition, 93(4), 844–850.[↩]
- Snowdon, D. A., & Phillips, R. L. (1985). Does a vegeterian diet reduce the occurrence of diabetes? American Journal of Public Health, 75(5), 507–512.[↩]
- Malik, V. S., Li, Y., Tobias, D. K., Pan, A., & Hu, F. B. (2016). Dietary protein intake and risk of type 2 diabetes in US men and women. American Journal of Epidemiology, 183(8), 715–728.[↩]
- Lin, Y., Mouratidou, T., Vereecken, C., Kersting, M., Bolca, S., De Moraes, A. C. F., Cuenca-García, M., Moreno, L. A., González-Gross, M., Valtueña, J., Labayen, I., Grammatikaki, E., Hallstrom, L., Leclercq, C., Ferrari, M., Gottrand, F., Beghin, L., Manios, Y., Ottevaere, C., … Navarro, P. (2015). Dietary animal and plant protein intakes and their associations with obesity and cardio-metabolic indicators in European adolescents: The HELENA cross-sectional study. Nutrition Journal, 14(1), 1–11.[↩]
- Pimpin, L., Jebb, S. A., Johnson, L., Llewellyn, C., & Ambrosini, G. L. (2018). Sources and pattern of protein intake and risk of overweight or obesity in young UK twins. British Journal of Nutrition, 120(7), 820–829.[↩]
- Spencer, E. A., Appleby, P. N., Davey, G. K., & Key, T. J. (2003). Diet and body mass index in 38 000 EPIC-Oxford meat-eaters, fish-eaters, vegetarians and vegans. International Journal of Obesity, 27(6), 728–734.[↩]
- Kittisakmontri, K., Lanigan, J., Wells, J. C. K., & Fewtrell, M. (2020). The impact of dietary protein in complementary foods on infant growth and body composition in a population facing the double burden of malnutrition: Protocol for a multicenter, prospective cohort study. JMIR Research Protocols, 9(9).[↩]
- Melnik, B. C., John, S. M., & Schmitz, G. (2013). Milk is not just food but most likely a genetic transfection system activating mTORC1 signaling for postnatal growth. Nutrition Journal, 12(1), 1.[↩]
- Najjar, R. S., & Feresin, R. G. (2019). Plant-based diets in the reduction of body fat: Physiological effects and biochemical insights. Nutrients, 11(11).[↩]
- Shang, X., Scott, D., Hodge, A., English, D. R., Giles, G. G., Ebeling, P. R., & Sanders, K. M. (2016). Dietary protein from different food sources, incident metabolic syndrome and changes in its components: an 11-year longitudinal study in healthy community-dwelling adults. Clinical Nutrition, 1–9. http://dx.doi.org/10.1016/j.clnu.2016.09.024[↩]
- Navas-carretero, S., San-cristobal, R., Livingstone, K. M., Celis-morales, C., Marsaux, C. F., Macready, A. L., Fallaize, R., Donovan, C. B. O., Forster, H., Woolhead, C., Moschonis, G., Lambrinou, C. P., Jarosz, M., Manios, Y., Daniel, H., Gibney, E. R., Brennan, L., Walsh, M. C., Drevon, C. A., … Mathers, J. C. (2018). Higher vegetable protein consumption , assessed by an isoenergetic macronutrient exchange model , is associated with a lower presence of overweight and obesity in the web-based Food4me European study. International Journal of Food Sciences and Nutrition, 0(0), 1–14.[↩]
- Celis-Morales, C., Livingstone, K. M., Marsaux, C. F. M., Forster, H., O’Donovan, C. B., Woolhead, C., Macready, A. L., Fallaize, R., Navas-Carretero, S., San-Cristobal, R., Kolossa, S., Hartwig, K., Tsirigoti, L., Lambrinou, C. P., Moschonis, G., Godlewska, M., Surwiłło, A., Grimaldi, K., Bouwman, J., … Mathers, J. C. (2015). Design and baseline characteristics of the Food4Me study: a web-based randomised controlled trial of personalised nutrition in seven European countries. Genes and Nutrition, 10(1).[↩]
- Campbell, E. K., Fidahusain, M., & Campbell, T. M. (2019). Evaluation of an Eight-Week Whole-Food Plant-Based Lifestyle Modification Program. Nutrients, 11.[↩]
- Kahleova, H., Fleeman, R., Hlozkova, A., Holubkov, R., & Barnard, N. D. (2018). A plant-based diet in overweight individuals in a 16-week randomized clinical trial: metabolic benefits of plant protein. Nutrition and Diabetes, 8(1).[↩]
- Klementova, M., Thieme, L., Haluzik, M., Pavlovicova, R., Hill, M., Pelikanova, T., & Kahleova, H. (2019). A plant-based meal increases gastrointestinal hormones and satiety more than an energy-and macronutrient-matched processed-meat meal in t2d, obese, and healthy men: A three-group randomized crossover study. Nutrients, 11(1), 1–10.[↩]
- Deibert, P., Lazaro, A., Schaffner, D., Berg, A., Koenig, D., Kreisel, W., Baumstark, M. W., Steinmann, D., Buechert, M., & Lange, T. (2019). Comprehensive lifestyle intervention vs soy protein-based meal regimen in non-alcoholic steatohepatitis. World Journal of Gastroenterology, 25(9), 1116–1131.[↩]
- Razavi, A. C., Bazzano, L. A., He, J., Whelton, S. P., Fernandez, C., Ley, S., Qi, L., Krousel-Wood, M., Harlan, T. S., & Kelly, T. N. (2020). Consumption of animal and plant foods and risk of left ventricular diastolic dysfunction: the Bogalusa Heart Study. ESC Heart Failure, 7(5), 2700–2710.[↩]
- Meng, S., Cui, Z., Li, M., Li, T., Wu, F., Kang, T., & Meng, H. (2021). Associations between dietary animal and plant protein intake and cardiometabolic risk factors—a cross-sectional study in china health and nutrition survey. Nutrients, 13(2), 1–19.[↩]
- Akter, S., Mizoue, T., Nanri, A., Goto, A., Noda, M., Sawada, N., Yamaji, T., Iwasaki, M., Inoue, M., Tsugane, S., Tsugane, S., Sawada, N., Iwasaki, M., Ninue, M., Yamaji, T., Goto, A., Shimazu, T. T., Charvat, H., Budhathoki, S., … Sakata, K. (2020). Low carbohydrate diet and all cause and cause-specific mortality. Clinical Nutrition, September, 1–9.[↩]
- Campbell, T. C., Parpia, B., & Chen, J. (1998). Diet, lifestyle, and the etiology of coronary artery disease: the Cornell China Study. American Journal of Cardiology, 82(10 B), 18–21.[↩]
- Clarke, R., Frost, C., Collins, R., Appleby, P., & Peto, R. (1997). Dietary lipids and blood cholesterol: quantitative meta-analysis of metabolic ward studies. Bmj, 314(7074), 112–117.[↩]
- Päivärinta, E., Itkonen, S. T., Pellinen, T., Lehtovirta, M., Erkkola, M., & Pajari, A. M. (2020). Replacing animal-based proteins with plant-based proteins changes the composition of a whole nordic diet—a randomised clinical trial in healthy Finnish adults. Nutrients, 12(4), 1–16.[↩]
- Bergeron, N., Chiu, S., Williams, P. T., M King, S., & Krauss, R. M. (2019). Effects of red meat, white meat, and nonmeat protein sources on atherogenic lipoprotein measures in the context of low compared with high saturated fat intake: a randomized controlled trial. American Journal of Clinical Nutrition, 110(1), 24–33.[↩]
- Desroches, S., Mauger, J.-F., Ausman, L. M., Lichtenstein, A. H., & Lamarche, B. (2004). Soy protein favorably affects LDL size independently of isoflavones in hypercholesterolemic men and women. The Journal of Nutrition, 134(3), 574–579.[↩]
- Li, S. S., Mejia, S. B., Lytvyn, L., Stewart, S. E., Viguiliouk, E., Ha, V., de Souza, R. J., Leiter, L. A., Kendall, C. W. C., Jenkins, D. J. A., & Sievenpiper, J. L. (2017). Effect of plant protein on blood lipids: A systematic review and meta-analysis of randomized controlled trials. Journal of the American Heart Association, 6(12).[↩]
- Richter, C. K., Skulas-Ray, A. C., Champagne, C. M., & Kris-Etherton, P. M. (2015). Plant protein and animal proteins: do they differentially affect cardiovascular disease risk? Advances in Nutrition, 6, 712–728.[↩]
- Tharrey, M., Mariotti, F., Mashchak, A., Barbillon, P., Delattre, M., & Fraser, G. E. (2018). Patterns of plant and animal protein intake are strongly associated with cardiovascular mortality: The Adventist Health Study-2 cohort. International Journal of Epidemiology, 47(5), 1603–1612.[↩]
- Song, M., Fung, T. T., Hu, F. B., Willett, W. C., Longo, V. D., Chan, A. T., Giovannucci, E. L., SJ, S., SM, S.-B., TP, W., N, S., SM, T., MS, W.-P., ME, L., LE, K., GA, C., EB, R., C, Y., MJ, S., … ES, F. (2016). Association of Animal and Plant Protein Intake With All-Cause and Cause-Specific Mortality. JAMA Internal Medicine, 176(10), 1453.[↩]
- Sharples, A. P., Hughes, D. C., Deane, C. S., Saini, A., Selman, C., & Stewart, C. E. (2015). Longevity and skeletal muscle mass: the role of IGF signalling, the sirtuins, dietary restriction and protein intake. Aging Cell, 14(4), 511–523.[↩]
- Solon-biet, S. M., Mcmahon, A. C., Ballard, J. W. O., Wu, L. E., Cogger, V. C., Warren, A., Huang, X., Pichaud, N., Melvin, R. G., Gokarn, R., Khalil, M., Turner, N., Cooney, G. J., Sinclair, D. A., Raubenheimer, D., & Le, D. G. (2014). The ratio of macronutrients, not caloric intake, dictates cardiometabolic health, aging, and longevity in ad libitum-fed mice. Cell Metab, 19(3), 418–430.[↩]
- López-Torres, M., & Barja, G. (2008). Lowered methionine ingestion as responsible for the decrease in rodent mitochondrial oxidative stress in protein and dietary restriction- possible implications for humans. Biochimica et Biophysica Acta, 1780, 1337–1347.[↩]
- Ganmaa, D., & Sato, A. (2005). The possible role of female sex hormones in milk from pregnant cows in the development of breast, ovarian and corpus uteri cancers. Medical Hypotheses, 65(6), 1028–1037.[↩]
- Fraser, G. E. (1999). Associations between diet and cancer, ischemic heart disease, and all-cause mortality in non-Hispanic white California seventh-day adventists. The American Journal of Clinical Nutritrion, 70, 532–538. http://ajcn.nutrition.org.sci-hub.cc/content/70/3/532s.long[↩]
- Huang, J., Liao, L. M., Weinstein, S. J., Sinha, R., Graubard, B. I., & Albanes, D. (2020). Association between plant and animal protein intake and overall and cause-specific mortality. JAMA Internal Medicine, 180(9), 1173–1184.[↩]
- Naghshi, S., Sadeghi, O., Willett, W. C., & Esmaillzadeh, A. (2020). Dietary intake of total, animal, and plant proteins and risk of all cause, cardiovascular, and cancer mortality: Systematic review and dose-response meta-analysis of prospective cohort studies. The BMJ, 370.[↩]
- Shepon, A., Eshel, G., Noor, E., & Milo, R. (2016). Energy and protein feed-to-food conversion efficiencies in the US and potential food security gains from dietary changes. Environmental Research Letters, 11(10).[↩]
- Schiermeier, Q. (2019). Eat less meat: UN climate-change report calls for change to human diet. Nature News.[↩]
- Heller, M. C., & Keoleian, G. A. (2015). Greenhouse gas emission estimates of U.S. dietary choices and food loss. Journal of Industrial Ecology, 19(3), 391–401.[↩]
- McCallum, M. L. (2015). Vertebrate biodiversity losses point to a sixth mass extinction. Biodiversity and Conservation, 24(10), 2497–2519.[↩]
- IUCN. (2007). Species extinction – The facts. International Union for the Conservation of Nature, Red List, 4. www.iucnredlist.org[↩]
- Beasley, J. M., Firestone, M. J., Popp, C. J., Russo, R., & Yi, S. S. (2020). Age and Racial/Ethnic Differences in Dietary Sources of Protein, NHANES, 2011–2016. Frontiers in Nutrition, 7(June), 1–11.[↩]
- David Weiner, I., & Verlander, J. W. (2017). Ammonia transporters and their role in acid-base balance. Physiological Reviews, 97(2), 465–494.[↩]
- Bernier-Jean, A., Prince, R. L., Lewis, J. R., Craig, J. C., Hodgson, J. M., Lim, W. H., Teixeira-Pinto, A., & Wong, G. (2020). Dietary plant and animal protein intake and decline in estimated glomerular filtration rate among elderly women: a 10-year longitudinal cohort study. Nephrology Dialysis Transplantation, 1–8.[↩]
- Rebholz, C. M., Coresh, J., Grams, M. E., Steffen, L. M., Anderson, C. A. M., Appel, L. J., & Crews, D. C. (2015). Dietary Acid Load and Incident Chronic Kidney Disease: Results from the ARIC Study. American Journal of Nephrology, 42(6), 427–435.[↩]
- Adair, K. E., & Bowden, R. G. (2020). Ameliorating chronic kidney disease using a whole food plant-based diet. Nutrients, 12(4), 8–18.[↩]
- Stephenson, T. J., Setchell, K. D. R., Kendall, C. W. C., Jenkins, D. J. A., Anderson, J. W., & Fanti, P. (2005). Effect of soy protein-rich diet on renal function in young adults with insulin-dependent diabetes mellitus. Clinical Nephrology, 64(1), 1–11.[↩]
- Viberti, G., Bognetti, E., Wiseman, M. J., Dodds, R., Gross, J. L., & Keen, H. (1987). Effect of protein-restricted diet on renal response to a meat meal in humans. American Journal of Physiology - Renal Fluid and Electrolyte Physiology, 253(3), 1–6.[↩]
- Bosch, J. P., Saccaggi, A., Lauer, A., Ronco, C., Belledonne, M., & Glabman, S. (1983). Renal functional reserve in humans. Effect of protein intake on glomerular filtration rate. The American Journal of Medicine, 75(6), 943–950.[↩]
- Kubota, M., Watanabe, R., Yamaguchi, M., Hosojima, M., Saito, A., Fujii, M., Fujimura, S., & Kadowaki, M. (2016). Rice endosperm protein slows progression of fatty liver and diabetic nephropathy in Zucker diabetic fatty rats. British Journal of Nutrition, 116(8), 1326–1335.[↩]
- Anderson, J. W. (2008). Beneficial effects of soy protein consumption for renal function. Asia Pacific Journal of Clinical Nutrition, 17.[↩]
- National Kidney Foundation. (n.d.). Plant-based diet and kidney health. Retrieved January 18, 2021, from https://www.kidney.org/atoz/content/plant-based[↩]
- Joshi, S., Shah, S., & Kalantar-Zadeh, K. (2019). Adequacy of plant-based proteins in chronic kidney disease. Journal of Renal Nutrition, 29(2), 112–117.[↩]
- Carrero, J. J., González-Ortiz, A., Avesani, C. M., Bakker, S. J. L., Bellizzi, V., Chauveau, P., Clase, C. M., Cupisti, A., Espinosa-Cuevas, A., Molina, P., Moreau, K., Piccoli, G. B., Post, A., Sezer, S., & Fouque, D. (2020). Plant-based diets to manage the risks and complications of chronic kidney disease. Nature Reviews Nephrology, 16(9), 525–542.[↩]
- Pesta, D. H., & Samuel, V. T. (2014). A high-protein diet for reducing body fat: mechanisms and possible caveats. Nutrition and Metabolism, 11(1), 1–8.[↩]
- Chalvon-Demersay, T., Azzout-Marniche, D., Arfsten, J., Egli, L., Gaudichon, C., Karagounis, L. G., & Tomé, D. (2017). A systematic review of the effects of plant compared with animal protein sources on features of metabolic syndrome. The Journal of Nutrition, 147, 281–292.[↩]
- Bianchi, C. M., Egnell, M., Huneau, J.-F., & Mariotti, F. (2016). Plant protein intake and dietary diversity are independently associated with nutrient adequacy in french adults. The Journal of Nutrition, 146(11), 2351–2360.[↩]